|
|||||||||||||||||||
| 3.1 Adhäsion 3.2 Theorien der Haftvorgänge 3.3 Theorien der Ablösevorgänge 3.4 Benetzungsverhalten 3.5 Kontaktwinkel 3.6 Oberflächenspannung / Oberflächenenergie 3.7 Grenzflächenspannung 3.8 Einfluss von Wasser 3.1 Adhäsion Als Adhäsion bezeichnet man das Haften zweier unterschiedlicher Stoffe aneinander. Beim Kontakt eines Feststoffes mit einem anderen Feststoff, einer Flüssigkeit oder einem Gas treten an der Grenzfläche der beiden Stoffe automatisch anziehende Wechselwirkungen zwischen den Teilchen auf, aus denen diese Stoffe bestehen. Diese Anziehungskraft zwischen den beiden Stoffen wird Adhäsion genannt, die als Widerstand gegenüber einer trennenden Beanspruchung des Verbundes auftritt. Dabei spenden bei der Haftverbindung der Haftpartner Bitumen / Mineralstoff beide Stoffe einen adhäsiven Beitrag. Adhäsive Eigenschaften von Asphalten machen sich in zweierlei Hinsicht bemerkbar: · Als Benetzung der Kornoberfläche durch das Bindemittel bei der Asphaltaufbereitung (aktive Haftung) · Als Verdrängungswiderstand des Bindemittelfilms von der Kornoberfläche durch Wasser während der Nutzungsdauer von Asphaltbelägen (passive Haftung). [16] Eine „aktive Haftung“ des Bitumens am Gestein findet statt, wenn das Bindemittel selbst in der Lage ist das Wasser von feuchten Gesteinsoberfläche zu verdrängen. Haftung unter Mitwirkung äußerer Kräfte, wie z.B. bei übermäßigem Porendruck, beschreibt die „passive Haftung“. Die „passive Haftung“ beschreibt somit den späteren dauerhaften Widerstand gegenüber einer Wasserverdrängung. [5] 3.2 Theorien der Haftvorgänge Um die Haftvorgänge zwischen Bitumen und Gestein beschreiben zu können, wurden unterschiedliche Adhäsionstheorien aufgestellt. In der Literatur sind verschiedene Theorien angegeben, von denen keine die Adhäsion im ausreichenden Maße umfasst. Letztlich müssen die chemischen und physikalischen Wechselwirkungen, sowie eine mechanische Verankerung zwischen den Verbundkomponenten im Zusammenhang betrachtet werden. Zur Überschaubarkeit sind hier ohne Anspruch auf Vollständigkeit vier Theorien dargestellt. 3.2.1 Mechanische Theorie Die mechanische Theorie erklärt die Haftung mit Hilfe des Modells der Verzahnung zwischen Gestein und Bitumen. Das flüssige Bitumen dringt in die Poren und Risse der Gesteinsoberfläche ein. Bei Abkühlung des Bindemittels kommt es zu einer Verankerung der beiden Stoffe. Bei dieser Theorie ist zu beachten, dass poröse Gesteinsoberflächen zu einer Vergrößerung der Kontaktoberfläche führen. Dies hat wiederum nach der Theorie der molekularen Orientierung eine Erhöhung der Adhäsion zur Folge. Vereinfacht sagt die mechanische Theorie im Vergleich zu einer glatten Oberfläche eine verbesserte Haftung bei rauen Gesteinsoberflächen aus. [18], [22] 3.2.2 Chemische Theorie Die chemische Theorie geht von einer chemischen Reaktion zwischen Bitumen und Mineralstoff aus. Untersuchungen des Haftungsvermögens an sauren und basischen Gesteinen haben deutliche Unterschiede gezeigt. Z.B. hat VOGLER unterschiedliche Gesteinsarten untersucht und dabei ein schlechteres Haftverhalten gegenüber sauren Gesteinen festgestellt. [24] In der Literatur ist die Theorie teilweise umstritten, da chemische Reaktionen irreversibel sind. Bitumen zeigt wiederum reversible Reaktionen in Anwesenheit von geeigneten Lösungsmitteln. [17] 3.2.3 Theorie der molekularen Orientierung Das Bitumen und die Oberfläche des Gesteins besitzen unterschiedliche Ladungen. Kommt es zur Berührung der beiden Stoffe orientieren sich die Moleküle des Bitumens in Richtung Grenzfläche. Sie richten sich so aus, dass sie den Energiebedarf der Gesteinsoberfläche sättigen. Bei diesem Ablauf wird ein negatives Molekül des Gesteins von einem positiv geladenen Molekül des Bitumens neutralisiert. 3.2.4 Thermodynamische Theorie Die thermodynamische Theorie wird auch als Theorie der Grenzflächenenergie bezeichnet. In der Literatur bekommt die Theorie großen Zuspruch. Sie beschreibt die Benetzung, Ausbreitung und Ablösung des Bitumens als einen thermodynamischen Ablauf, der von der Oberflächenenergie der Stoffe abhängig ist. Dabei wird der Einfluss der Polarität der Moleküle besonders berücksichtigt. So konnte beim Benetzungsvorgang ein Energieverlust durch Abgabe von Immersionswärme (Benetzungswärme) festgestellt werden. Polare Flüssigkeiten werden im Vergleich zu nichtpolaren Flüssigkeiten von Gesteinsoberflächen verstärkt angezogen. Diese Theorie unterstreicht das Verhalten von Wasser. Wasser ist eine stark polare Flüssigkeit. Diese Eigenschaft könnte das Ablösen des Bitumens vom Gestein begründen. [17], [18] 3.3 Theorien der Ablösevorgänge Für das Versagen der Haftverbindung zwischen Mineralstoff und Bitumen sind zwei Ursachen zu nennen: · Unzureichende Kohäsion innerhalb des Bitumens · Mangelnde Adhäsion an der Grenzfläche: Bitumen – Mineralstoff Die Hauptursache für Adhäsionsfehler ist der Einfluss von Wasser. Bei getrockneten Mineralstoffe mit sauberer Oberfläche sind meist nur Haftverluste durch fehlende Kohäsion im Bitumen zu erwarten, sofern kein Wasser anwesend ist. 3.3.1 Porendrucktheorie In Asphaltschichten können sich in den Poren bzw. den Hohlräumen Porendrücke in Anwesenheit von Wasser entwickeln. Zusätzlich sind Porendrücke durch Dampfdrücke zu erwarten. Die Porendrücke sind entweder mechanischen oder thermischen Ursprungs. Das Wasser dringt dabei in die unterschiedlich großen Poren im Asphalt ein. Durch die Beanspruchung infolge Radüberrollungen wird das Wasser in die Poren gedrückt, woraufhin hohe Porendrücke entstehen können. Es kann zu Bindemittelablösungen kommen, sobald die entstehenden Kräfte aus den Porendrücken die adhäsiven Kräfte zwischen Bitumen und Gestein übertreffen. Porendrücke die sich aus thermischen Effekten entwickeln, sind durch die Volumenzunahme des Bitumens und Wassers begründend. In den Hohlräumen des Asphalts dehnt sich das vorhandene Wasser infolge Temperaturzunahme aus. Es entstehen Spannungen innerhalb der Hohlräume, die die Haftung zwischen Bitumen und Mineralstoff zerstören können. [17],[18], [19] 3.3.2 Verdrängungstheorie Die Verdrängungstheorie geht von einer Störung des Gleichgewichtszustandes zwischen Bitumen und Mineralstoff in Anwesenheit von Wasser aus. Diese Theorie greift, wenn das Gestein von vornherein nicht vollständig mit Bitumen umhüllt war. Das Wasser findet infolgedessen Zutritt zur Grenzfläche Mineralstoff / Bitumen und verdrängt aufgrund der höheren Oberflächenspannung bzw. polaren Anteile das Bitumen. Die Verdrängung des Bitumens ist dabei von dessen Viskosität abhängig. Hochviskose Bitumen haben einen höheren Widerstand bei der Verdrängung durch Wasser. Die Verdrängung des Bitumens wird in Abbildung 4 deutlich. Die Berührungsstelle A befindet sich nach Wasserzutritt nicht mehr im Gleichgewicht und zieht sich zur Berührungsstelle B zurück. In dieser Lage stellt sich für das Bitumen und dem Kontaktwinkel des eingesetzten Gesteins ein Gleichgewicht ein. [17], [18] 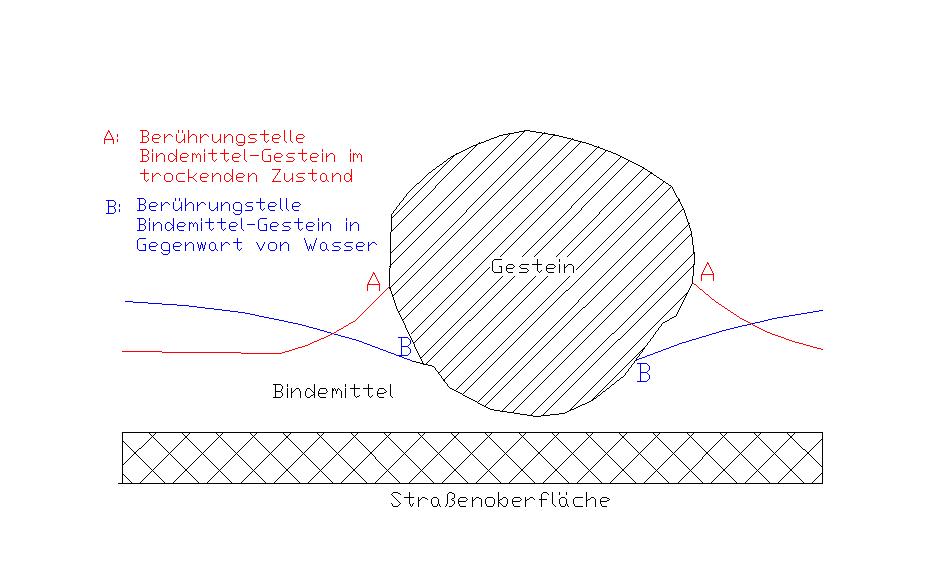 Abb.4:
Zurückdrängen des Bindemittels auf der
Gesteinsoberfläche durch Wasser [18]
Diese Vorstellung der Bindemittelverdrängung trifft in der Praxis zu wenn: · Mineralstoff nicht vollständig mit Bitumen umhüllt · Das Bitumen hat seine endgültige Viskosität noch nicht erreicht (Regenfälle beim Einbau mit heißem Asphalt) · Bei Splittverlusten auf der Asphaltoberfläche 3.3.3 Unterwanderungstheorie Bei dieser Theorie wird die Haftverbindung zwischen Bitumen und Gestein gestört, indem das Bitumen an der Grenzfläche durch den Einfluss von Feuchtigkeit unterwandert wird. Die Bitumenumhüllung am Gestein bleibt dabei erhalten. In diesem Fall rückt Feuchtigkeit, die aus dem Inneren des Gesteins oder von außerhalb stammt, an die Grenzfläche vor und bildet einen dünnen Wasserfilm. Die Feuchtigkeit aus dem Gesteinsinneren gelangt dabei durch Kapillare an die Grenzfläche. Von außerhalb diffundiert die Flüssigkeit im flüssigen oder gasförmigen Zustand durch den Bitumenfilm hindurch. Die Geschwindigkeit ist von der Filmdicke des Bitumens und dessen Wasserdurchlässigkeit abhängig. Zu einer verstärkten Unterwanderung kann es bei mit Staub verunreinigten Gesteinsoberflächen kommen. In Gegenwart von Wasser an der Gesteinsoberfläche kommt es bei den meisten Gesteinsarten zur Bildung negativer Ladungen im Bitumen. Da beide Oberflächen die gleiche Ladung aufweisen, stoßen sie sich ab. Infolgedessen wird der Ablösevorgang durch das vermehrte Eindringen von Wasser verstärkt. Untersuchungen nach HUGHES (1960) haben eine vermehrte Ablösung bei Mineralien mit hohem Quarz und Feldspat ergeben. Zusätzlich wurde besonders bei niedrigviskosen Bitumen eine Wiederverklebung in trockener Umgebung nach vorherigem Zustand der Trennung beobachtet. [17], [18], [22] 3.3.4 Filmbruchtheorie Die Filmbruchtheorie geht von einem Bruch des Bitumenfilms infolge dynamischer Lasteinwirkungen aus Verkehrslast aus. Besonders an scharfen Kanten und Ecken, wo der Bitumenfilm am dünnsten ist, ist ein Riss des Films zu erwarten. Durch den Riss des Bitumenfilms ist die vollständige Umhüllung gestört, so dass eindringendes Wasser das Bindemittel weiter verdrängen kann. [18] 3.4 Benetzungsverhalten Die Benetzung ist die Wirkung, die aus dem Streben eines Festkörpers resultiert, mit einer Flüssigkeit eine möglichst große gemeinsame Grenzschicht zu bilden, die Flüssigkeit also auf der Festkörperoberfläche zu einem Film spreiten zu lassen. Demgegenüber hat eine Flüssigkeit das Bestreben, selbst eine möglichst kleine Oberfläche auszubilden, also einen kugelförmigen Tropfen zu erzeugen. Die Benetzung an der Grenzfläche wird folglich durch das Gleichgewicht aus Adhäsion und Kohäsion bestimmt. Die Oberflächenspannung der Flüssigkeit (Kohäsion) verkleinert die Oberfläche, die Adhäsion zieht die Oberfläche längs der angrenzenden Fläche auseinander. Somit ist die Benetzung um so besser, je größer die Beweglichkeit der Moleküle in der Flüssigkeit ist. Demzufolge nehmen mit abnehmender Viskosität die Kohäsionskräfte, die den Dipolkräften zwischen den Molekülen des Bitumens und des Gesteins entgegenwirken, ab. [8] Benetzungsfälle:
Diese beiden gegenläufigen Bestrebungen führen zu einem Gleichgewichtszustand, der sich beispielsweise an einem Flüssigkeitstropfen auf einer Festkörperoberfläche beobachten lässt. Wie sich dieser Tropfen ausbildet, hängt vom Verhältnis der freien Oberflächenenergien der drei beteiligten Phasen (Flüssigkeit, Festkörperoberfläche, umgebendes Medium) ab. Im Allgemeinen reicht es, bei Abwesenheit von Wasser, nur die Flüssigkeit und die Festkörperoberfläche zu betrachten, da die umgebende Luft nur eine geringe Rolle für die Benetzung spielt. Die Benetzungsfähigkeit kann nach HARKINS und FELDMAN mit dem sogenannten Spreitungsdruck dargestellt werden. Der Spreitungsdruck Dsl ergibt sich aus der Differenz zwischen der Adhäsionsarbeit und Kohäsionsarbeit der Flüssigkeit. Die Kohäsionsarbeit folgt aus Wsl = σs + σl – σsl. Da die Grenzflächenspannung sich zu Null ergibt, ist die Kohäsionsarbeit: Wl = 2 · σl Spreitungsdruck: Dsl = Wsl – Wl kombiniert mit: Wsl = σs + σl – σsl und Wl = 2 · σl Dsl = σs – (σl + σsl) Die Gleichung gibt Aufschluss auf den Einfluss der Oberflächenspannung der Phasen. Ein positiver Spreitungsdruck wird erreicht, wenn die Oberflächenspannung des Feststoffes σs größer als die Oberflächenspannung der Flüssigkeit σl ist. Somit kann Bitumen nur Mineralstoffe größerer Oberflächenspannung bzw. Energie benetzen. Das Benetzungsverhalten wird maßgeblich von der Viskosität des Bitumens beeinflusst. Bitumen mit einem niedrigen Härtegrad bzw. geringer Viskosität breiten sich auf einer festen Oberfläche nach Einstellung des Gleichgewichtzustandes weiter aus. Der Ausbreitungsdurchmesser ist im Vergleich mit einem Bitumen hoher Viskosität größer. [12] Ein übliches Maß für die Benetzung ist der Kontaktwinkel zwischen einem Flüssigkeitstropfen und einer Festkörperoberfläche. Der Kontaktwinkel wird zwischen der Festkörperoberfläche und der Tangente der Flüssigkeitsoberfläche an der Stelle, wo sie die Festkörperoberfläche berührt, gemessen. Das Benetzungsverhalten bezeichnet die Fähigkeit von Flüssigkeiten, sich auf einer Oberfläche auszubreiten; je besser die Benetzbarkeit, umso kleiner ist der bei der Benetzung auftretende Kontaktwinkel. Die häufig vertretende Meinung, nach der die Benetzung mit abnehmender Oberflächenspannung zunimmt, trifft nicht im Allgemeinen zu. Die Benetzung hängt immer von den Wechselwirkungen beider beteiligten Phasen Mineralstoff und Bitumen ab. [16] 3.5 Kontaktwinkel Bei einer optimalen Benetzung spreitet eine Flüssigkeit auf einer Oberfläche, verteilt sich also in einer dünner werdenden Schicht selbstständig über immer größere Flächen. Bei dem Spreiten der Flüssigkeit müssen die adhäsiven Kräfte größer sein als die kohäsiven Kräfte und die Oberflächenspannung der Auflagerfläche größer als die der spreitenden Flüssigkeit. Bei guter Benetzung erhält man einen relativ flachen Tropfen mit großer Berührungsfläche zur Oberfläche. Bei schlechter Benetzung besitzt der Tropfen die Form einer mehr oder weniger abgeflachten Kugel und perlt von der Oberfläche ab. Mit Hilfe des Kontaktwinkels q lässt sich die Qualität der Benetzbarkeit quantitativ erfassen. Flüssigkeiten besitzen neben solchen Eigenschaften wie der Dichte oder Viskosität auch die der Oberflächenspannung. [22] Der Kontaktwinkel ist von Heterogenitäten, Fremdstoffen und von der Rauheit der zu benetzenden Oberfläche abhängig. Deshalb ist es in der Praxis schwierig, aufgrund des Benetzungsgrades Aussagen über die Adhäsion zu formulieren. Der Benetzungswinkel ist daher kein Maß für die Höhe der an der Grenzschicht vorhandenen Bindungskräfte, sondern er beschreibt lediglich die Benetzungsverhältnisse. Im Allgemeinen kann man feststellen, dass eine gute Benetzung gegeben ist, wenn die Oberflächenenergie eines Feststoffes größer als die Oberflächenspannung der Flüssigkeit ist. Nur in diesem Fall wird eine Substanz einer Oberfläche adsorbiert. Die Benetzung eines Stoffes mit Wasser und Luft als umgebendem Medium hängt vom Verhältnis der Grenzflächenspannungen Wasser/Luft, Festkörper/Wasser und Festkörper/Luft ab. Das Verhältnis der Spannungen bestimmt z.B. den Kontaktwinkel eines Wassertropfens auf einer Oberfläche. Ein Kontaktwinkel von 0° bedeutet vollständige Benetzung, das heißt, ein Wassertropfen zerläuft zu einem Film (Abb.: 5). Ein Kontaktwinkel von 180° bedeutet vollkommene Unbenetzbarkeit, der Tropfen berührt die Oberfläche in nur einem Punkt. Stoffe mit einer hohen Oberflächenenergie werden besser benetzt als solche mit niedriger Oberflächenenergie, wie z.B. PTFE (TEFLON®) Benetzungsarten:
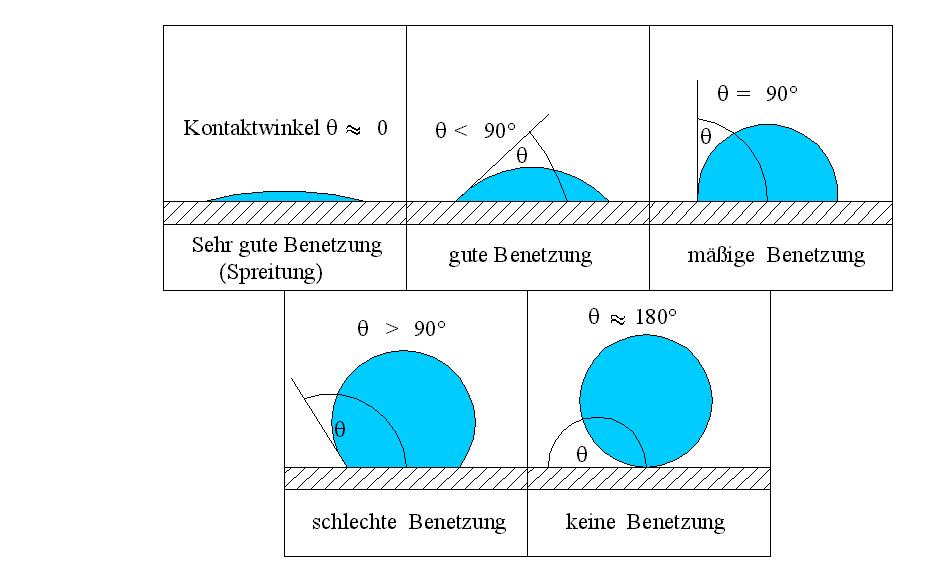 Abb.5: Benetzungsarten 3.6 Oberflächenspannung / Oberflächenenergie Die Oberflächenspannung einer Flüssigkeit stellt eine wichtige Einflussgröße auf das Adhäsionsvermögen dar. Die Oberflächenspannung beschreibt den Spannungszustand an der Grenzfläche zwischen zwei Stoffen. Unter einer Oberfläche versteht man die sichtbare Fläche einer Flüssigkeit oder eines Festkörpers, die an ein undefiniertes Gas, z.B. die normale Umgebungsluft, grenzt. Der Begriff Grenzfläche bezeichnet die Fläche zwischen zwei festen oder flüssigen bzw. festen gegen flüssigen Phasen. Mit abnehmender Oberflächenspannung nimmt die Benetzungsfähigkeit des Bitumens zu. [18] Die Ursache für die Oberflächenspannung sind Wechselwirkungskräfte zwischen benachbarten Molekülen. Im Inneren ist die resultierende Kraft im Mittel Null und das Molekül befindet sich im Gleichgewicht. Wenn ein Molekül an der Flüssigkeitsoberfläche betrachtet wird, fehlt ein Teil der Wechselwirkungen mit anderen Molekülen. Es findet eine Wechselwirkung mit den Molekülen des darrüberliegenden Gases bzw. Dampfes statt. Als resultierende Kraft wirkt auf das Molekül an der Oberfläche eine nach innen, senkrecht zur Oberfläche gerichtete Kraft (Abb.: 6). Daher bilden Flüssigkeiten Formen, die durch die kleinstmögliche Oberfläche (Kugelform) gekennzeichnet sind. Die Größe der Oberflächenspannung nimmt somit mit steigender molekularer Anziehungskraft im Innern zu.  Abb.6: Schema der Oberflächenspannung Da Flüssigkeiten bestrebt sind Minimaloberflächen zu bilden, müssen zur Vergrößerung der Flüssigkeitsoberfläche Moleküle aus dem Inneren in die Grenzschicht gebracht werden. Dazu muss Arbeit W verrichtet werden, wobei die potentielle Energie steigt. Um die potentielle Energie zu einem Minimum werden zu lassen, neigt ein Flüssigkeitstropfen dazu, eine möglichst geringe Oberfläche in Form einer Kugel zu bilden. Die Zunahme der Oberflächenenergie ΔW ist proportional der Oberflächenvergrößerung ΔA. Oberflächenspannung:
[J/m2 , N/m]
Die Oberflächenspannung σ ist demnach ein Maß für den Energiegehalt der Oberfläche, bzw. eine zur Vergrößerung der Oberfläche definierte Arbeit, dividiert durch den Zuwachs der Fläche. Die Oberflächenspannung wird in der Einheit Energiegehalt pro Fläche erfasst. Die Oberfläche von Festkörpern kann nicht reversibel vergrößert oder verkleinert werden. Bei Festkörpern muss neben der nötigen Arbeit zur Schaffung neuer Oberfläche auch Arbeit aufgewandt werden, um Bindungen zu brechen, die den Festkörper zusammenhalten. Man spricht deshalb bei festen Oberflächen nicht von Oberflächenspannung, sondern von Oberflächenenergie. [20] In der Literatur sind für Bitumen Oberflächenspannungen zwischen 25 mN/m und 30 mN/m bei Temperaturen von 100°C und 150°C angegeben. HUTSCHENREUTHER gibt eine nahezu Unabhängigkeit der Oberflächenspannung von den verwendeten Rohölen (Provenienzen), Herstellungsarten und Bitumenhärten an. Ergebnisse aus Oberflächenspannungsmessungen von E. THELEN (1958) ergaben eine geringe Spreizung der Ergebnisse. Die Oberflächenspannung an elf verschiedenen Bitumen wurden mit 25,8 +- 0,6 mN/m bei 25°C bestimmt. Mit je 10°C Temperaturerhöhung nahm die Oberflächenspannung um 0,8 mN/m ab. [23] 3.7 Grenzflächenspannung Bringt man zwei Flüssigkeiten oder eine Flüssigkeit und einen Festkörper in Kontakt, so kommt es an der Grenzfläche zu molekularen Wechselwirkungen. Für die Interpretation von Kontaktwinkelmessungen sind die elektrostatischen Anziehungskräfte zwischen Dipolen von besonderer Bedeutung. Man unterscheidet dabei die Wechselwirkungen zwischen statischen und induzierten Dipolen, die als "Van der Waals-Kräfte" bezeichnet werden. "Van der Waals-Kräfte" ist die allgemeine Bezeichnung für die anziehenden intermolekularen Kräfte. Sie umfassen die physikalischen Wechselwirkungen zwischen permanenten Dipolen (Abb.: 7), die Induktionswechselwirkungen zwischen Dipolen und polarisierbaren Molekülen und die Dispersionswechselwirkungen (auch London-Kräfte genannt). OWENS, WENDT, RABEL und KAEBLE entwickelten zum erstem Mal die Vorstellung, dass sich die Grenzflächenenergie entsprechend der zugrundeliegenden Wechselwirkungen zwischen den Molekülen aufspalten lässt. Sie unterschieden zwischen dispersen Wechselwirkungen und polaren Wechselwirkungen. Unter polaren Wechselwirkungen werden Wechselwirkungen zwischen permanenten Dipolen und zwischen permanenten und induzierten Dipolen zusammengefasst. Disperse Wechselwirkungen werden als die Anziehung zwischen induzierten Dipolen beschrieben. [13] Die Wechselwirkungen aufgrund von zeitlichen Veränderungen in der Ladungsverteilung innerhalb der Moleküle werden als disperse Wechselwirkungen bezeichnet. Polarer und dispersiver Beitrag zur Oberflächenspannung setzen sich additiv zusammen. Demnach gilt: Flüssigkeit: σl = σld + σlp Feststoff: σs = σsd + σsp Die inneren Kräfte der Adhäsion werden üblicherweise in zwei Gruppen, den polaren und unpolaren Wechselwirkungen geordnet. Unter Dispersionswechselwirkungen versteht man die London – Kräfte. Zu den polaren Wechselwirkungen zählen die Debye (Dipol-induzierter Dipol), Keesom (Dipol-Dipol) und Wasserstoffbrückenbrückenbindungen. 
Tab.10:
Wechselwirkungen: polare / disperse Anteile
3.7.1 molekulare Wechselwirkungen Moleküle, die eine unsymmetrische Verteilung von Ladungen haben, besitzen ein permanentes oder statisches Dipolmoment. Bekanntestes Beispiel ist Wasser. Diese Moleküle werden auch als polar bezeichnet. Wenn sich zwei polare Moleküle bzw. permanente Dipole (Abb.: 7a) einander nähern, so findet eine elektrostatische Wechselwirkung zwischen den Dipolen statt. Wenn sich ein polares Molekül einem unpolaren Molekül mit symmetrischer Ladungsverteilung nähert (Abb.: 7b), so induziert es in dem polarisierbaren Molekül ein Dipolmoment. Zwischen dem permanenten Dipol des ersten Moleküls und dem induzierten Dipol des zweiten Moleküls findet jetzt eine Wechselwirkung statt. Die beiden Moleküle ziehen sich gegenseitig an. 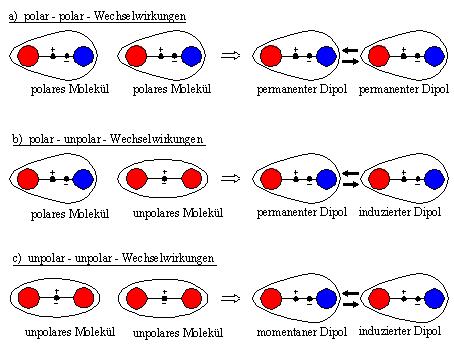 Abb.7: Schematische
Darstellung der anziehenden Wechselwirkungen [2]
Zur Diskussion der Wechselwirkung zwischen zwei nicht-polaren Molekülen, wie sie in Abbildung 7c dargestellt ist, betrachtet man die Moleküle im Abstand R zueinander. Sie haben zwar keine permanenten Dipolmomente, dennoch verändert sich die Position ihrer Elektronen und somit die Ladungsschwerpunkte. Sie haben daher ein momentanes Dipolmoment, das zeitlich variiert. Diese momentanen Dipole können im benachbarten Molekül einen Dipol induzieren, woraus eine Anziehungskraft resultiert. Diese Wechselwirkung zwischen induzierten Dipolen wird auch Dispersions-wechselwirkung genannt, die dabei auftretenden Kräfte werden nach ihrem Entdecker “London-Kräfte” benannt. In nichtpolaren Molekülen bildet die Dispersionswechselwirkung den Hauptanteil. Sie entsteht durch Schwankungen der elektrischen Felder in den Atomen. Ein gemeinsames Merkmal der wirkenden Kräfte ist, dass sie nur wirksam werden können, wenn die reagierenden Phasen gegenseitig nur einen sehr geringen Abstand zueinander haben. 3.7.2 Bestimmung der Grenzflächenspannung Zur Bestimmung der Oberflächenspannungen bzw. der Grenzflächenspannung existieren zahlreiche Verfahren. Ein weit verbreitetes Verfahren ist die Methode des liegenden Tropfens (sessile drop), bei der im Dreiphasensystem fest / flüssig / gasförmig der Kontaktwinkel (oder auch Randwinkel) θ als Maß für die Benetzbarkeit eines Werkstoffes angesehen werden kann. Dieser Kontaktwinkel wird aus dem Profil eines Flüssigkeitstropfens auf einer ebenen Festkörperoberfläche ermittelt. Das Kräfteverhältnis, das an der Kontaktfläche der drei Phasen Luft, Flüssigkeit (liquid: l) und Festkörper (solid: s) besteht, wird durch die YOUNG‘sche Gleichung beschrieben. Young’sche
Gleichung ( 1 )
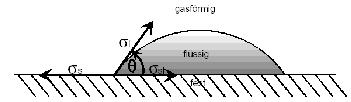 Abb.8:
Flüssigkeit auf Festkörper
σsl : Grenzflächenspannung zwischen Phase1 und Phase 2 σ1 : Oberflächenenergie der Flüssigkeit σs : Oberflächenenergie des Festkörpers Bei der Ausbildung einer gemeinsamen Grenzfläche zwischen fester Oberfläche und Flüssigkeit wird die Energie W gewonnen. Diese sogenannte Adhäsionsenergie W wird definiert als die Arbeit, die geleistet werden muss, um eine Grenzfläche von 1cm2 Querschnitt zu trennen.. [20] Unter Beachtung der Normierung der Gleichung auf die Fläche, ist also die Adhäsionsenergie Wsl gleich der Differenz der Summe der Oberflächenspannung der Flüssigkeit und der Oberflächenenergie des festen Körpers, vermindert um die Grenzflächenspannung.
Durch das Einsetzten der Young’schen Gleichung erhält man folgende Formel:
Die Formel sagt aus, dass die Energie der Adhäsion von der Oberflächenspannung des Bindemittels und von dem sich einstellenden Winkel θ, der wiederum von den Oberflächeneigenschaften des Mineralstoffes abhängt, beeinflusst wird. Entsprechend den grundlegenden molekularen Wechselwirkungskräften kann man die Adhäsionsarbeit in Anteile aufteilen. Praxisgerecht wird für die meisten Anwendungen eine Unterscheidung zwischen Dispersionswechselwirkungen und polaren Wechselwirkungen gemacht: W = Wpolar – Wdispers
(4)
Der disperse Anteil bezieht sich auf die London-Kräfte, also der Wechselwirkung zwischen induzierten Dipolen, und tritt damit an jeder Phasengrenze auf. Damit polare Anteile auftreten können, sind polare Moleküle, also Moleküle mit permanentem Dipolmoment, nötig. Die Grenzflächenenergien können ebenso in Anteile aufgespalten werden, die sich additiv verhalten:
Grenzflächenenergie: σp = polarer Anteil σd= disperser Anteil Die Grenzflächenspannung σsl jeder Phase lässt sich demnach in polare und disperse Anteile zergliedern. Nach OWENS, WENDT, RABEL und KAELBLE gilt folgende Gleichung:
Während der disperse Anteil die Dispersionskräfte (London-Wechselwirkungen) beinhaltet, geht in den polaren Anteil alle Nichtdispersionskräfte ein. Die Auftrennung der Oberflächenspannung in die beiden Anteile ist vor allem hinsichtlich der Adhäsion von Bedeutung, da ein gutes adhäsives Verhalten eines Festkörpers mit einem hohen polaren Anteil einher geht. Unpolare Materialien, wie z.B. PTFE (TEFLON®), weisen hingegen nur niedrige bis gar keine polaren Anteile auf. [12], [13] 3.8 Einfluss von Wasser Das Auftreten von Wasser ist als Hauptgrund bei Ablösevorgängen im Asphalt anzusehen. Die Praxis hat gezeigt, dass bei hohlraumreichen Asphaltschichten vermehrt Haftungsschäden festgestellt werden konnten. Betrachtet man einen Tropfen Bindemittel auf einer Gesteinsoberfläche, wird der negative Einfluss des Wassers auf die Haftung deutlich. Das Bindemittel zieht sich durch die Einwirkung von Wasser im fortschreitenden Ablösevorgang zu einer Kugel zusammen, die letztlich ihre Haftung am Gestein verliert. 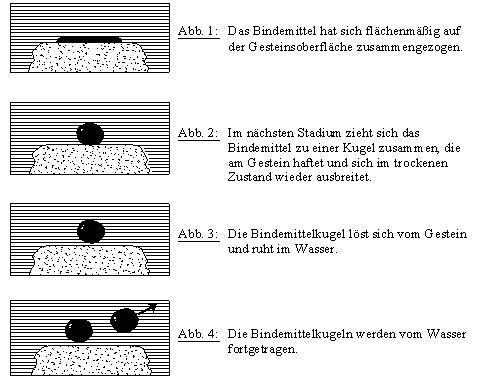 Abb.9: Bindemittelablösung infolge Wassereinwirkung auf Gesteinsoberfläche [14] Wasser ist eine dipolare Flüssigkeit. Ein Dipol besitzt einen positiven und einen negativen Ladungsmittelpunkt. Die Ladungsmittelpunkte haben einen festen Abstand zueinander und können daher keine Verbindung eingehen. Die dipolaren Wassermoleküle werden von einer hydrophilen Mineralstoffoberfläche leicht angezogen, damit sättigen sich die im Ungleichgewicht befindlichen Oberflächenladungen. Der Literatur ist zu entnehmen, dass der pH-Wert des Wassers einen bedeutsamen Einfluss auf das Haftverhalten zwischen Bitumen und Bindemittel ausübt. Es wurde belegt, dass ein hoher pH-Wert das Haftverhalten an basischen Mineralstoffen und ein niedriger pH-Wert an sauren Mineralstoffen verbessert. In der Literatur gibt es über das Haftverhalten zwischen Mineralstoff und Bitumen unter Einfluss von unterschiedlichen pH-Werten des Wassers keine konkreten Nachweise. [17] |
|||||||||||||||||||
| Copyright © 2014, Stephan Korn www.HausUrlaub.de | |||||||||||||||||||